(通訊員 吳浩)近日,國際學術期刊Redox Biology以 “Defective mitochondrial ISCs biogenesis switches on IRP1 to fine tune selective mitophagy”為(wei) 題在線發表了我院微量元素營養(yang) 生理生化團隊的最新研究成果,揭示了哺乳動物細胞鐵代謝與(yu) 線粒體(ti) 穩態的重要關(guan) 係,為(wei) 進一步闡明鐵穩態失衡相關(guan) 疾病的病理機製指明了方向。
鐵是重要的微量元素,參與(yu) 了電子傳(chuan) 遞及氧化磷酸化、氧氣運輸與(yu) 呼吸作用、DNA複製轉錄及損傷(shang) 修複等重要的生物學過程。細胞內(nei) 過量的鐵可通過介導Fenton反應催化脂質過氧化,誘導細胞氧化損傷(shang) ,並與(yu) 多種人類疾病的發生發展緊密相關(guan) 。因此,細胞內(nei) 鐵穩態及鐵代謝受到多種機製的精確調控,早期研究表明鐵缺乏可損傷(shang) 線粒體(ti) ,重構細胞代謝模式,但其分子機製仍不清楚。
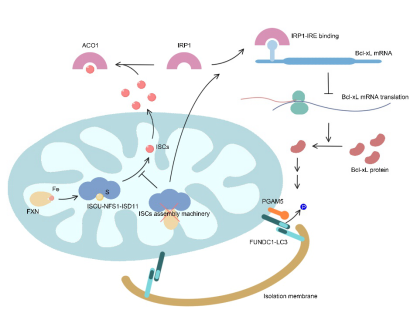
在本研究中,利用鐵螯合劑處理誘導細胞鐵匱乏,研究發現鐵缺乏可激活自噬體(ti) -溶酶體(ti) 途徑依賴的線粒體(ti) 降解(即線粒體(ti) 自噬),且該線粒體(ti) 自噬高度依賴於(yu) 線粒體(ti) 自噬受體(ti) 分子FUNDC1,敲低FUNDC1顯著抑製該線粒體(ti) 自噬的發生。線粒體(ti) 是細胞鐵代謝的中心,胞質中鐵被轉運至線粒體(ti) 基質用以合成血紅素及鐵硫簇,該二者是多種代謝緊密相關(guan) 蛋白的活性中心。通過siRNA篩選實驗,研究發現鐵硫簇合成異常亦可誘導FUNDC1依賴的線粒體(ti) 自噬,表明鐵硫簇合成異常是鐵缺乏誘導線粒體(ti) 自噬的重要原因。細胞鐵代謝及鐵硫簇水平主要受鐵調節蛋白IRP1的調控,當細胞鐵缺乏或鐵硫簇合成異常時,沒有足夠的鐵硫簇與(yu) IRP1結合,導致IRP1遊離並結合到一類含有IRE(鐵調節元件)的mRNA上,調節這些靶mRNA的翻譯或穩定性,調控相應蛋白的表達,繼而維持細胞鐵穩態並調控鐵代謝。研究發現鐵缺乏及鐵硫簇合成異常誘導的線粒體(ti) 自噬同樣受IRP1的調節,敲低IRP1顯著抑製該線粒體(ti) 自噬的水平。通過生物信息學分析,研究團隊發現FUNDC1介導的線粒體(ti) 自噬的關(guan) 鍵調控蛋白Bcl-xL的mRNA上含有一個(ge) 典型的IRE序列,IRP1通過結合該IRE抑製Bcl-xL的翻譯。本研究因而鑒定出鐵/鐵硫簇-IRP1-Bcl-xL-FUNDC1軸在線粒體(ti) 自噬及線粒體(ti) 穩態中的核心調節作用,同時本研究首次發現鐵硫簇是線粒體(ti) 自噬及線粒體(ti) 質量控製的關(guan) 鍵內(nei) 源性調節因子,該研究結果對於(yu) 進一步認識鐵穩態失衡相關(guan) 疾病的病理機製具有重要的指導意義(yi) 。
中國科學院生物物理研究所秦燕研究員及張德玖副研究員參與(yu) 並指導了本研究工作,本研究得到了國家自然科學基金等項目的資助。我院吳浩研究員、中國科學院動物研究所劉壘研究員及南開大學生命科學學院陳佺教授為(wei) 文章共同通訊作者,我院吳浩研究員及鄭州大學魏慧芳博士為(wei) 文章共同第一作者。
論文鏈接:



