南湖新聞網訊(通訊員 汪楚琪 陳玉坤)近日,我校農(nong) 業(ye) 微生物資源發掘與(yu) 利用全國重點實驗室、湖北洪山實驗室、動物醫學院申邦教授團隊在人獸(shou) 共患寄生原蟲——弓形蟲的營養(yang) 代謝機製研究方麵取得重要進展。該團隊發現定位於(yu) 弓形蟲頂質體(ti) 的一類全新的丙酮酸轉運蛋白(Apicoplast Pyruvate Carriers, APCs),並解析其生物學功能,為(wei) 抗弓形蟲藥物研發提供了新的靶標。研究結果以“ A pyruvate transporter in the apicoplast of apicomplexan parasites”為(wei) 題在國際知名學術期刊PNAS(美國國家科學院院刊)上發表。

研究成果在PNSA上在線發表
弓形蟲屬於(yu) 頂複門,是一種單細胞真核生物,能夠引起弓形蟲病。該人畜共患病導致孕婦和孕畜的流產(chan) 、畸形胎兒(er) 及免疫缺陷病人的死亡,對世界公共衛生和動物健康養(yang) 殖產(chan) 生巨大威脅。作為(wei) 真核病原微生物,弓形蟲除了擁有真核細胞典型的細胞器結構和生物膜係統外,還具有一種獨特的細胞器——頂質體(ti) 。頂質體(ti) 擁有活躍而複雜的代謝活動幫助蟲體(ti) 完成胞內(nei) 寄生,它與(yu) 葉綠體(ti) 相似,均被認為(wei) 是由“內(nei) 共生”事件演化而來,但與(yu) 葉綠體(ti) 相比,它失去了光合作用的能力,並且擁有4層生物膜結構。該細胞器是弓形蟲體(ti) 中重要的代謝場所,其活性對弓形蟲在人和動物體(ti) 內(nei) 建立感染十分重要,因此被視為(wei) 抗弓形蟲藥物開發的良好靶標。
領域內(nei) 傳(chuan) 統觀念認為(wei) ,頂質體(ti) 中的丙酮酸是由PYK2(丙酮酸激酶2)催化PEP(磷酸烯醇式丙酮酸)產(chan) 生。該團隊通過前期研究發現:PYK2並非頂質體(ti) 中丙酮酸的主要來源,缺失後並不影響蟲體(ti) 的生長與(yu) 毒力,暗示頂質體(ti) 中的丙酮酸供應可能主要來自蟲體(ti) 細胞質(mBio, 2019)。但頂質體(ti) 擁有4層膜包裹的特殊結構,它是如何使丙酮酸從(cong) 細胞質進入其中的呢?尋找能將丙酮酸運送到頂質體(ti) 的轉運蛋白是本項研究解決(jue) 的主要科學問題。
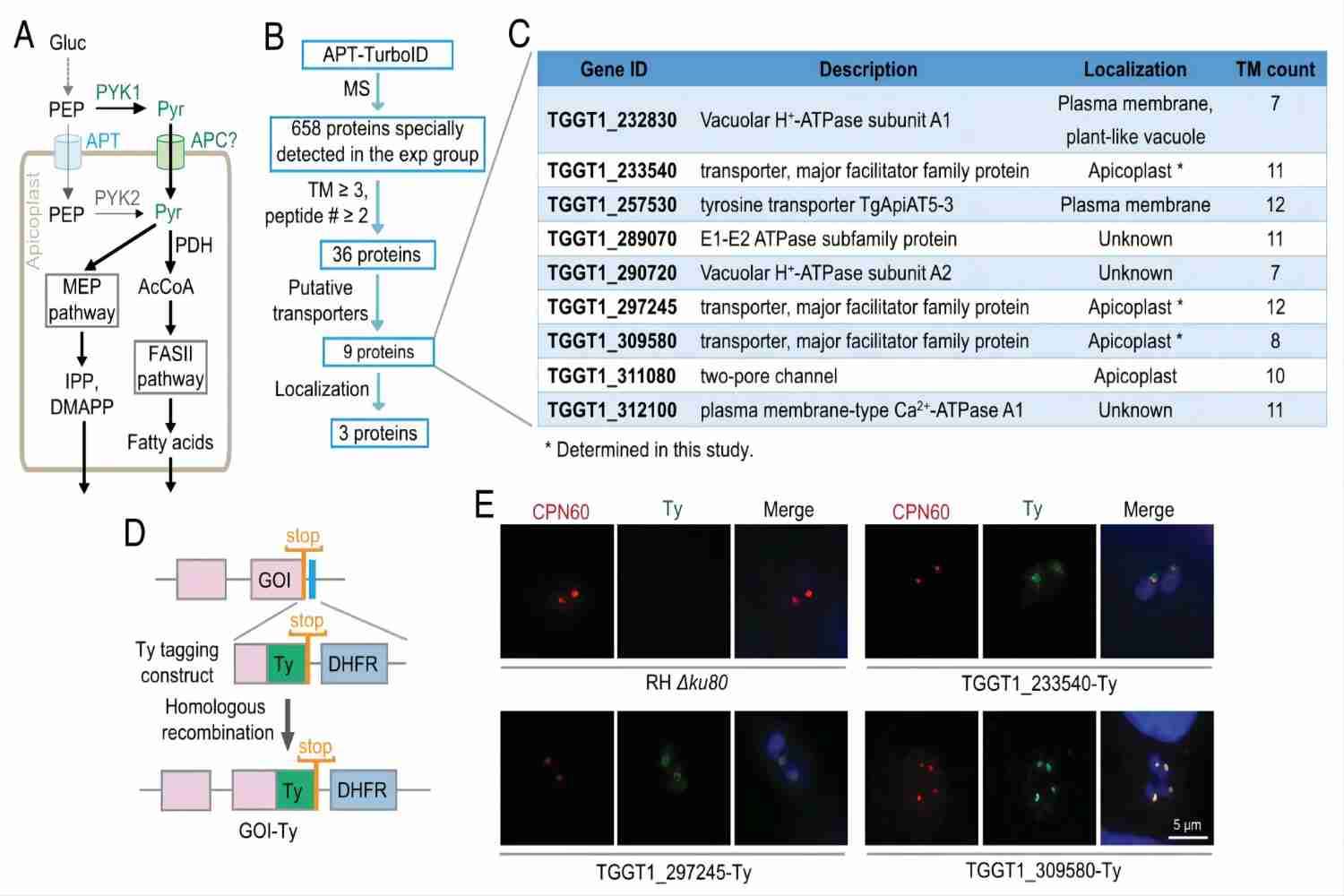
圖1. 頂質體(ti) 丙酮酸轉運蛋白的篩選鑒定
丙酮酸轉運蛋白的研究是代謝領域的重點和難點。經過近半個(ge) 世紀的研究,科學家僅(jin) 發現兩(liang) 類定位於(yu) 細胞器的丙酮酸轉運蛋白——它們(men) 分別定位於(yu) 線粒體(ti) (Science,2012)和葉綠體(ti) (Nature,2011)。弓形蟲體(ti) 內(nei) 存在真核細胞中保守的線粒體(ti) 丙酮酸轉運蛋白(MPC),但是沒有與(yu) 葉綠體(ti) 丙酮酸轉運蛋白(BASS2)同源的蛋白。因此本研究利用蛋白臨(lin) 近標記技術篩選潛在的頂質體(ti) 丙酮酸轉運蛋白(圖1),最終發現兩(liang) 個(ge) 定位於(yu) 弓形蟲頂質體(ti) 膜上的丙酮酸轉運蛋白(apicoplast pyruvate carrier, APC),通過相互結合共同發揮轉運胞質中丙酮酸進入頂質體(ti) 基質的功能。借助CRISPR/Cas9基因編輯技術敲低APC後,對弓形蟲頂質體(ti) 的完整性及其代謝活性產(chan) 生重要影響,最終導致蟲體(ti) 生長停滯。通過序列比對發現,APC與(yu) 目前已知的細胞器丙酮酸轉運蛋白MPC、BASS2均沒有氨基酸序列上的同源性,是一類全新的丙酮酸轉運蛋白。APC在蟲體(ti) 代謝和生長中起關(guan) 鍵作用,並且僅(jin) 存在於(yu) 弓形蟲等含有頂質體(ti) 的寄生原蟲中(圖2),宿主細胞不編碼同源蛋白。這些特征使其具有成為(wei) 新型抗寄生蟲藥物靶標的潛力。
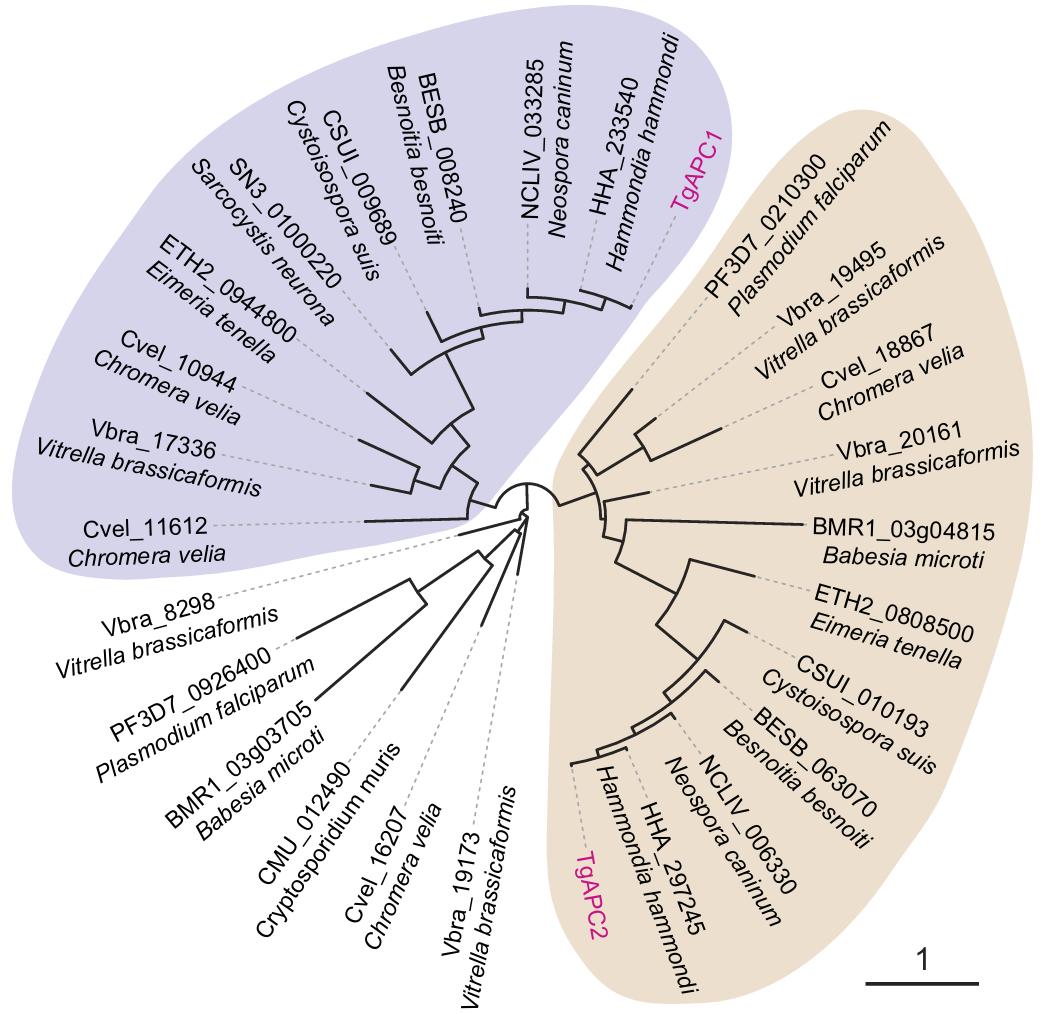
圖2. 頂質體(ti) 丙酮酸轉運蛋白在頂複門原蟲中的分布
陳譜、陳玉坤、夏寧波為(wei) 該文章的共同第一作者,申邦教授為(wei) 通訊作者。星空体育网站入口官网動物醫學院博士研究生範柏林、牛誌鵬、何政明、廈門大學生命科學學院博士後王旭參與(yu) 本研究,廈門大學生命科學學院袁晶教授,德國柏林洪堡大學生命科學學院、印度Birla 科技學院Nishith Gupta教授對本研究提供重要指導意見和建議。該研究獲得國家重點研發計劃(2022YFD1800200)、國家自然科學基金中德合作基金(31961133032)等項目的資助。
原文鏈接:
審核:申邦



